文章题目:Single-cell transcriptome analysis revealed the immune profileof PD-1 blockade in gallbladder carcinoma liver metastasis
合作单位:复旦大学附属肿瘤医院
发表期刊:Hepatology Communications(IF:5.701)
研究背景与目的:胆囊癌是胆道最常见的癌症,免疫检查点阻断在晚期胆囊癌的治疗中有良好的疗效,本文致力于研究其潜在的机制。
实验对象:aPD-1治疗前后的胆囊癌肝转移患者肝组织
研究队列:
①7胆囊癌肝转移患者治疗前后scRNAseq数据
②4个胆道癌和3个免疫治疗的BulkRNA-seq数据集
检测手段:BD Rhapsody scRNA-seq
主要结果展示:
01、aPD-1疗法增加GCLM微环境中的整体T细胞浸润
在aPD-1治疗前后,共获得了19,648个高质量的肝转移单细胞转录组数据。无监督聚类分群后得到6个细胞亚群。研究人员观察到,在aPD-1治疗后,NK/T细胞在细胞群中占了大部分,而上皮细胞几乎无法识别。

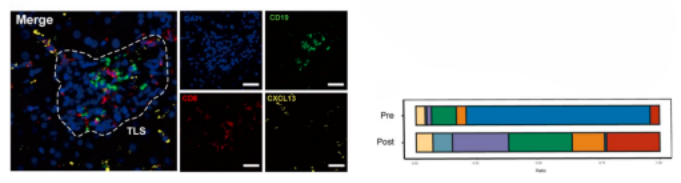
治疗后,效应和记忆T细胞,细胞毒性T细胞的比例增加,耗竭的T细胞(Tex)减少。通过多色IHC染色进一步证实了CD8-CXCL13 T细胞的存在,格式化了三级淋巴结构,反应性肿瘤在基线时具有高末端Tex浸润。
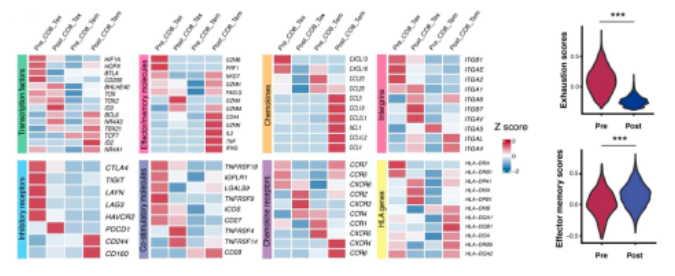
02、aPD-1治疗后CD8+T细胞的细胞毒性增强
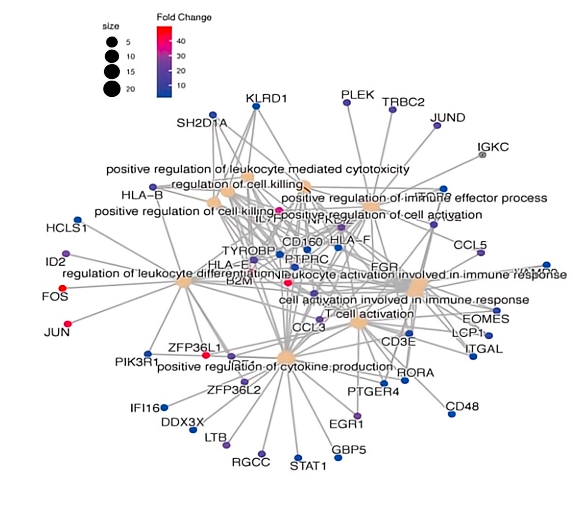
Tem和Tex集群中,进行aPD-1治疗后诱导的转录动力学检测。aPD-1治疗后Tem表现出增强的细胞毒性。转录组学分析表明效应和记忆相关基因、转录因子、TCR信号相关基因、共刺激分子等基因均表达上调,而衰竭相关基因在aPD-1治疗后下调。此外,治疗后上调的基因在T细胞活化途径,细胞因子产生有正向调节,白细胞介导的细胞毒性,免疫效应过程和白细胞分化中富集,进一步表明其在aPD-1阻断治疗后增强的效应特性。
03、具有祖Tex特征的短暂状态的扩展Tem簇
据报道aPD-1通过靶向前体耗竭的T细胞来增强抗肿瘤免疫力,研究者们进一步研究了它们是否与前体Tex具有相似的性质。在3个Tem和Tex簇中进行的SCENIC 分析发现,EOMES和TBX21在Tem簇中高表达,这是耗竭T细胞发育生物学中的关键转录因子。对报告的前体Tex细胞(干性的和暂时性的细胞)特征基因的GSEA分析显示,CD8_C3_CCL3 Tem和CD8_C4_COTL1 Tem与Tex prog1的相似性最高,而CD8_C6_KLRD1 Tem与中间Tex细胞相似。
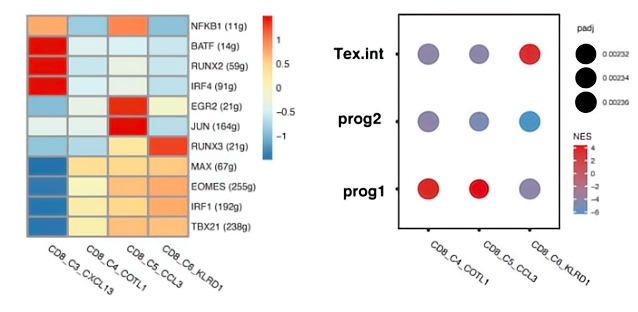
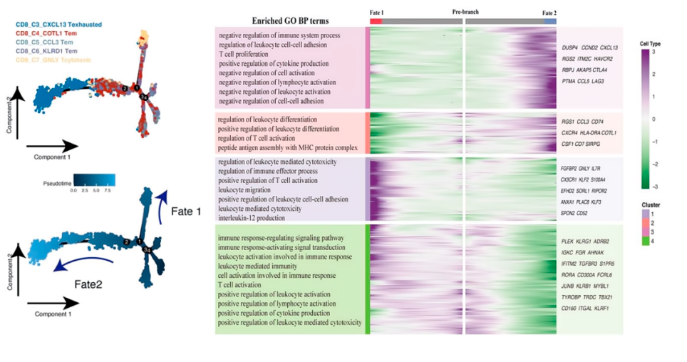
拟时序分析确定了CD2 + T细胞中分化命运。Fate1细胞分化为GNLY+T细胞,与T细胞活化,免疫效应过程和白细胞介导的细胞毒性信号相关。Fate2 细胞分化为 CXCL13 T 细胞,与 T 细胞活化、细胞因子产生以及免疫系统过程途径的负调节有关。结果表明,3个Tem亚群处于暂时状态,能够分化为细胞毒性细胞或耗竭细胞。
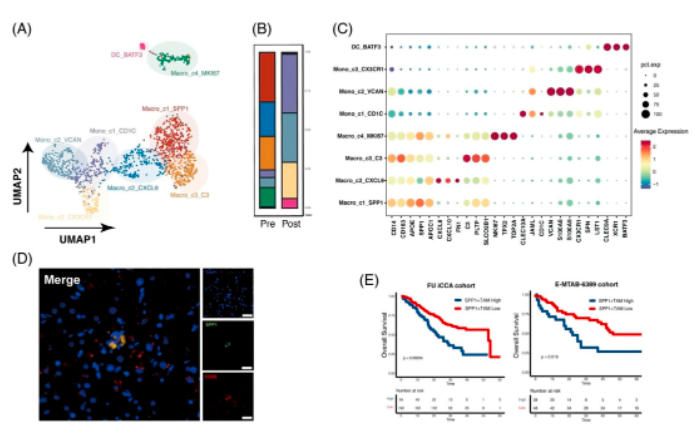
04、aPD-1疗法改变髓系细胞的组成和转录谱以及抗肿瘤应答反应
髓系细胞的亚群可以再细分到8个亚群。巨噬细胞簇在基线样品中富集,而单核细胞簇在aPD-1治疗后的髓系细胞中占多数。代表抗炎巨噬细胞的高表达SPP1和TREM1的SPP2 + TAMs是恶性的,并且仅在结直肠肝转移中富集。来自 2个肝内胆管癌(ICC)队列的Bulk RNA-seq 数据集显示,SPP1+TAM 高过滤率的患者与总生存期差有关。
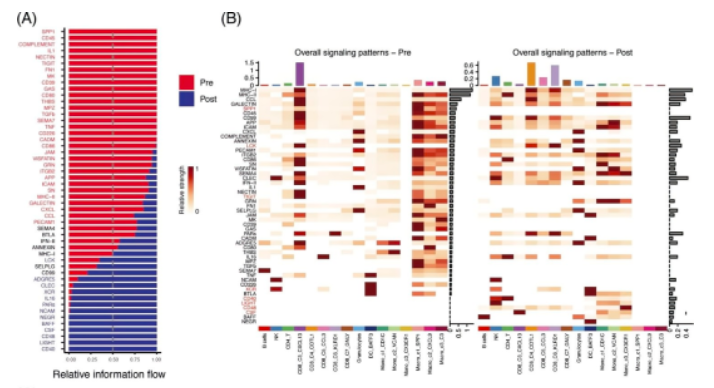
05、aPD-1疗法可能促进T细胞活性并缓解抑制性微环境
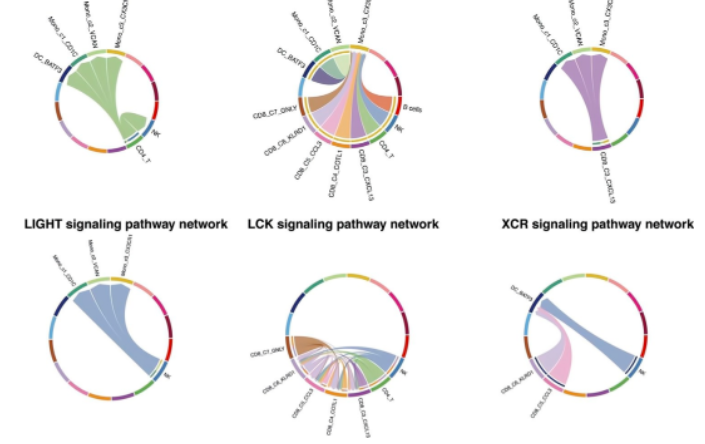
CellChat分析鉴定所有免疫细胞中响应aPD-1的受体配体的变化。比较aPD-1治疗前后信号通路的显着整体信息流发现:aPD-1治疗后富集的相互作用包括CD40-CD40L,驱动效应CD8 + T细胞的活化和启动;LIGHT-LTβR,使肿瘤脉管系统正常化,促进肿瘤免疫细胞浸润;CD48-CD244,调节效应/记忆T细胞生成;LCK-CD8A/CD8B,与TCR信号传导和T细胞发育有关;和XCR-XCL1 / XCL2,参与Ag交叉呈现。也注意到增强的CSF1-CSFR1相互作用,它可以使肿瘤进入血管,从而促进肿瘤转移,表明其可能是潜在的治疗靶点。
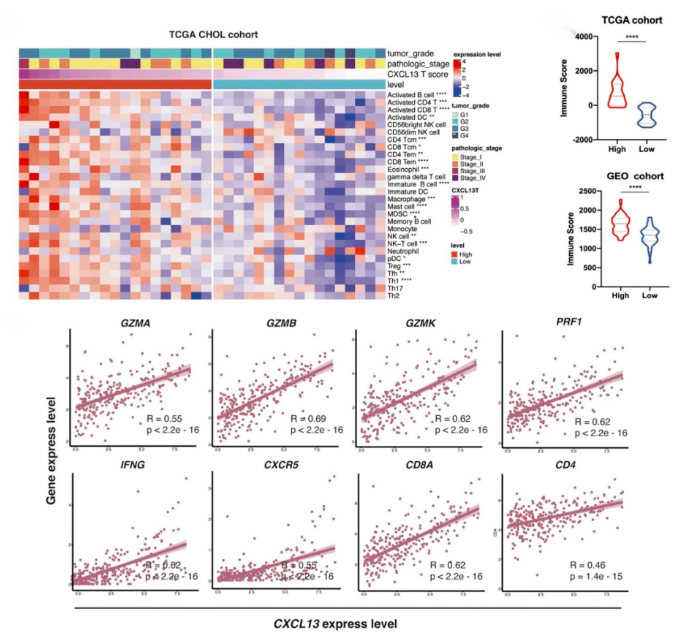
06、高 CXCL13+T 浸润与炎症免疫表型相关,高 CXCL13+CD8+T 细胞浸润与免疫治疗的良好反应相关
GLM中的肿瘤浸润CXCL13 + CD8 + T细胞代表了一种高度耗竭的亚型。TCGA胆管癌队列的免疫浸润热图分析表明,TME具有高水平的CXCL13 + T细胞浸润,与更多活化的B细胞、T细胞、DC和巨噬细胞相关,及通过估算出的免疫评分显着更高,表明存在免疫炎症表型。进一步分析Fu-ICC队列的mRNA表达,发现CXCL13的表达T细胞浸润的抗肿瘤免疫应答呈正相关。这些数据表明,CXCL13与T细胞的细胞毒性活性增强有关。高CXCL13+T细胞浸润构建了一个“热”免疫TME,可能是BTC的一个良好的预后因素。
总结
本研究揭示了PD-1阻断GLM免疫谱的变化,并确定CXCL13 + T细胞作为潜在的预后生物标志物,以及CXCL13 + CD8 T细胞作为响应BTC免疫治疗的有利预测因子。未来需要更大量的aPD-1治疗BTC患者队列来验证研究者们的发现。


